В частности в соответствии с Договором о Евразийском экономическом союзе от 29 мая 2014 года, Соглашением о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза от 23 декабря 2014 года, Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 78 «О Правилах регистрации и экспертизы лекарственных средств для медицинского применения», Решением Совета Евразийской экономической комиссии от 03.11.2016 N 88 «Об утверждении требований к инструкции по медицинскому применению лекарственных препаратов и общей характеристике лекарственных препаратов для медицинского применения», с 2021 года все страны-участницы ЕАЭС обязаны проводить регистрацию лекарственных средств (ЛС) по единым правилам. После этого они вносятся в Единый реестр медицинских средств. Следование единым правилам повышает доступность препаратов в этих странах, а значит улучшает качество жизни населения ЕАЭС.
Как происходит регистрация лекарств?
Чтобы зарегистрировать медицинский препарат по всем правилам ЕАЭС,и он был внесен в официальный реестр, производитель должен пройти через определенную процедуру:
- Приведение всей документации в соответствии с новыми требованиями.
- Прохождение необходимых клинических исследований.
- Сбор регистрационного досье и его передача в Министерство здравоохранения.
- Минздрав проводит проверку ЛС на качество, безопасность, а также эффективность. Возможен выезд инспекции на производство.
- Если решение положительное, то производитель оплачивает государственные пошлины стран, где планируется продавать лекарственное средство.
- Страны, где будет продаваться медикамент, должны согласовать результаты экспертизы.
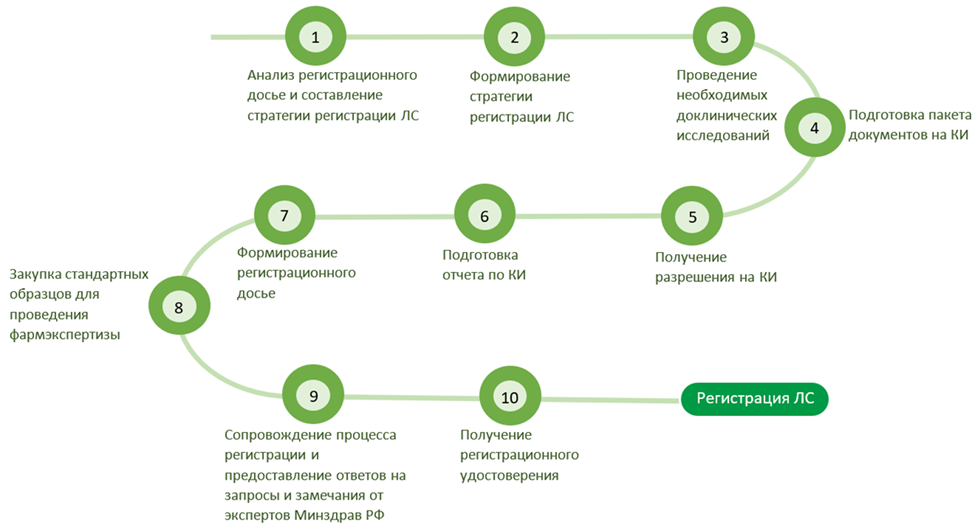
Агентство ResearchView предлагает полный перечень услуг по подготовке и подаче регистрационного досье, включая подготовку документов и ответы на запросы от экспертов Минздрава РФ:
- Анализ нормативной документации;
- Разработка проекта общей характеристики лекарственного препарата;
- Разработка проекта листка-вкладыша;
- Организация проведения и подготовка отчета пользовательского тестирования листка-вкладыша;
- Рекомендации по оценке комплектности и содержания разделов регистрационного досье;
- Подготовка заявления на государственную регистрацию;
- Подготовка электронной версии и форматирование регистрационного досье в xml-формате;
- Валидация подготовленного регистрационного досье в кабинете заявителя, подача комплекта документов в Министерство здравоохранения;
- Консультативная помощь Заказчику при подготовке документов для ответа на запрос уполномоченного органа;
- Комплектация документов и форматирование регистрационного досье в xml-формате в рамках ответа на запрос/-ы;
- Получение решения о направлении на фармацевтическую экспертизу;
- Мониторинг фармацевтической экспертизы;
- Консультативная помощь Заказчику при подготовке документов для ответа на запрос/-ы уполномоченного органа,
- Комплектация документов и создание новой электронной версии регистрационного досье в xml-формате и подача комплекта документов в ответ на запросы уполномоченного органа;
- Мониторинг экспертизы после подачи ответа на запрос/-ы уполномоченного органа;
- Получение утвержденного комплекта документов Министерством здравоохранения вместе с регистрационным удостоверением по окончании экспертизы.

















